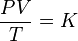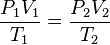lunes, 29 de febrero de 2016
lunes, 22 de febrero de 2016
Preguntas

¿Que son los colores?
Es la impresión producida por un tono de luz en los órganos visuales, o más exactamente, es una percepción visual que se genera en el cerebro de los humanos y otros animales al interpretar las señales nerviosas que le envían los foto receptores en la retina del ojo, que a su vez interpretan y distinguen las distintas longitudes de onda que captan de la parte visible del espectro electromagnético.¿Que tiene que ver la luz con la formación de los colores?
- Transparentes: Permiten que la luz se propague en su interior en una misma dirección, de modo que vuelve a salir. Así, se ven imágenes nítidas. Ejemplos: Vidrio, aire, agua, alcohol, etc.
- Opacos: Estos materiales absorben la luz o la reflejan, pero no permiten que los atraviese. Por tanto, no se ven imágenes a su través. Ejemplos: Madera. metales, cartón, cerámica, etc.
- Translúcidos: Absorben o reflejan parcialmente la luz y permiten que se propague parte de ella, pero la difunden en distintas direcciones. Por esta razón, no se ven imágenes nítidas a su través. Ejemplos: folio, tela fina, papel cebolla, etc.
La luz blanca se compone de los diferentes colores del arco iris: violeta, azul, verde, amarillo, naranja y rojo.
¿Por que los seres humanos podemos percibir los colores?
Nuestro sentido de la visión nos permite distinguir una amplia variedad decolores. La vista es el sentido que más utilizamos y del que mayor dependencia tenemos en casi todas las actividades, por lo que raramente nos preguntamos cómo funciona. Para comprender cómo percibimos los colores antes que nada debes saber qué son los colores y cómo se forman
¿Que relación tiene la frecuencia de la luz con la formación y la percepción de los colores?
La luz se mueve en el vacío aproximadamente a 300.000 km/s, y mientras no interactúa con la materia y llega a nuestros ojos no la vemos. El espacio está lleno de luz y sin embargo lo vemos oscuro.
Cuando una radiación luminosa incide sobre un cuerpo parte de la luz se refleja, parte se transmite a través de él y el resto, correspondiente a determinadas longitudes de ondas, es absorbida por el cuerpo.
Dentro de las sustancias transparentes la luz va a menor velocidad que en el vacío y una parte de ella siempre es absorbida debido a su interacción con los electrones de la materia. Podemos ver la luz difundida por la superficie (luz reflejada) o la transmitida por el cuerpo si es traslúcido. Al interactuar la luz con la materia es cuando se produce el color.
Cuando una radiación luminosa incide sobre un cuerpo parte de la luz se refleja, parte se transmite a través de él y el resto, correspondiente a determinadas longitudes de ondas, es absorbida por el cuerpo.
Dentro de las sustancias transparentes la luz va a menor velocidad que en el vacío y una parte de ella siempre es absorbida debido a su interacción con los electrones de la materia. Podemos ver la luz difundida por la superficie (luz reflejada) o la transmitida por el cuerpo si es traslúcido. Al interactuar la luz con la materia es cuando se produce el color.
La percepción de la luz y el color se rige por mecanismos extraordinariamente complejos y ricos en detalles en los que el ojo en sí mismo no es un mero captador de señales que se envían al cerebro, sino un dispositivo capaz de pre-procesar la señal recibida.
La retina del ojo humano tiene cuatro tipos de células sensibles a la luz. Tres de ellas, las denominadas conos, tienen distintas sensibilidades a las radiaciones del espectro, e intervienen en la visión normal (fotópica) y en la percepción de los colores.
El cuarto tipo de células, los bastones, son extraordinariamente sensibles a la luz de intensidad muy baja, y colaboran a la visión en semi-oscuridad (en la denominada visión nocturna o escotópica), pero no tienen influencia en la formación de imágenes en condiciones normales de iluminación. Existen unos 6 millones de conos y 100 millones de bastones en cada ojo, aunque su distribución no es uniforme. La mayor concentración se produce en la mácula, que es la zona donde percibimos mayor finura en los detalles.
¿Si esta oscuro, por que no vemos los colores?
En concreto tenemos dos tipos de células fotoreceptoras; los conos(color azul en el vídeo), capaces de distinguir colores; y los bastones(color negro), mucho más sensibles a la luz pero sin distinción de colores.
Con esto ya podemos entender que cuanta menos luz, menos fotones nos llegarán, menos estímulos recibe el cerebro y por lo tanto menos información en forma de imágen tenemos disponibles; sencillo.
¿Los objetos ya tienen los colores definidos?
El color de un objeto depende de lo que le sucede cuando la luz incide sobre él. Los diferentes materiales absorben algunos colores y reflejan otros. Los colores que vemos son los colores reflejados por el objeto. Por ejemplo, una hoja de color verde absorbe todos los colores excepto el color verde. La hoja refleja el color verde y ése es el color que vemos. Las cosas de color negro absorben todos los colores y no reflejan ninguno. Las cosas de color blanco reflejan todos los colores. Un filtro cromático absorbe ciertos colores de la luz y deja pasar otros.
Los colores rojo, azul y verde son los colores primarios de la luz. Al mezclar estos colores se pueden producir todos los colores del espectro. La retina del ojo tiene células sensibles a los colores de la luz. Algunas células responden sólo al rojo. Otras responden al verde. Hay otras células que responden solamente al color azul. Si sobre la retina inciden cantidades iguales de luz roja, azul y verde, vemos blanco. Pero cuando sólo inciden el rojo y el verde, vemos amarillo.
Los colores que resultan de mezclar pigmentos son diferentes de los colores que resultan de mezclar luces de colores. El magenta, el cian y el amarillo son llamados pigmentos primarios. Un objeto que tenga cualquiera de estos colores absorbe un color primario de la luz y refleja los otros dos. Cuando se mezclan apropiadamente estos pigmentos se puede crear el color que se desee al reflejar una mezcla de los colores primarios de la luz. La mayoría de los colores que vemos son combinaciones de dos o más colores.
Conclusión sobre los colores
Los colores no son más que un producto de la mente. El cerebro ve diferentes colores cuando el ojo humano percibe diferentes frecuencias de luz. La luz es una radiación electromagnética, igual que una onda de radio, pero con una frecuencia mucho mas alta y una longitud de onda más corta.El ojo humano sólo está capacitado para percibir un rango limitado de estas frecuencias, intervalo que se denomina “espectro visible de la luz”, y que abarca desde los tonos rojos del orden de los 705 nanómetros (nm) hasta los tonos azul violáceos del orden de los 385 nm, pasando por todos los colores intermedios.
La retina del ojo está cubierta por pequeños receptores sensibles a la luz, es decir, por una serie de células visuales denominadas bastoncillos y conos. Los bastoncillos son sensibles a la luz, pero no al color. Utilizamos los bastoncillos para ver con escasa iluminación -en la oscuridad todo se percibe como blanco y negro.
Los conos son menos sensibles a la luz, pero pueden percibir los colores. Hay tres tipos de conos, cada uno de los cuales es especialmente sensible a una parte específica del espectro visible: a los colores rojos, a los verdes y a los azules, respectivamente. Esta combinación permite percibir todos los colores del espectro visible -aproximadamente 10 millones de matices o sombras, muchos más de los que se pueden reproducir en la impresión en cuatricomía.
Optica Ondulatoria

Óptica:
Es la parte de la física que estudia el comportamiento de la luz y los fenómenos que produce. como por ejemplo los anteojos que ayudan a corregir los problemas visuales.
Óptica Geométrica:
Es conocida como óptica de rayos. Es la que estudia los fenómenos de la naturaleza corpuscular que se origina cuando la luz se considera como cuando se encuentran con obstáculos como espejos a eso se le llama reflexión.
Teoría Corpuscular:
Indica que la luz esta formada por corpúsculos (Partículas) emitido por cuerpos luminosos como una flama o el sol.
Teoría Ondulatoria de Huygens:
Se ocupa de los fenómenos de difracción, interferencia y polarización, que pueden explicarse admitiendo la naturaleza ondulatoria de la luz. Supone que la luz se propaga según ondas transversales. Los rayos luminosos son las trayectorias perpendiculares a la superficie de la onda.
Teoría Electromagnética:
Consiste en el análisis de los campos eléctricos y magnéticos, su comportamiento sobre los diferentes medios y que permiten el funcionamiento y operación de los dispositivos y sistemas eléctricos o electrónicos.
Teoría Cuántica:
Es una disciplina de la física que aplica los principios de la mecánica cuántica a los sistemas clásicos de campos continuos, por ejemplo, el campo electromagnético. Una consecuencia inmediata de esta teoría es que el comportamiento cuántico de un campo continuo es equivalente al de un sistema de partículas n 1 cuyo número no es constante, es decir, que pueden crearse o destruirse. También se la denomina teoría de campos cuánticos.
Comportamiento Dual de la Luz:
La luz tiene una doble naturaleza se comporta como ondas electromagnéticas al momento de propagarse y la otra de forma postular al momento de actuar sobre la materia. La luz se comporta como una onda y como una partícula. Las partículas de luz se llaman “fotones” cuya energía es
E = h • ν siendo “h” la constante de Planck y “ν” la frecuencia de la luz considerada }
Propiedades de la luz:
Algunas propiedades de la luz dependen del tipo de fuente luminosa que las emita, como el color, la intensidad. Sin embargo, existen otras propiedades como la reflexión y la refracción, que son comunes a todos los tipos de la luz.
- La reflexión de la luz es el cambio de dirección que experimenta la luz cuando choca contra un cuerpo.
- Los espejos son cuerpos opacos, con una superficie lisa y pulimentada, capaces de reflejar la luz que reciben.
- Los espejos pueden ser planos o esféricos.
- Los espejos planos forman imágenes igual de grandes que los objetos que las originan.
- Los espejos esféricos forman imágenes distorsionadas.
- La refracción de la luz. Es el cambio de dirección que experimenta la luz cuando pasa de un medio a otro diferente, por ejemplo, cuando pasa del aire al agua.
- La refracción de la luz sirve para ver los objetos con un tamaño diferente del real. Esto se consigue con el uso de lentes.
- Las lentes son cuerpos trasparentes con la superficie curva que refractan la luz. Pueden ser: Convergentes. Hacen que los rayos se junten. Las lupas son lentes convergentes. Divergentes. Hacen que los rayos se separen.
Fuentes de la producción de la luz:
Son las herramientas principales de las que los profesionales del audiovisual nos valemos para nuestro trabajo; independientemente de cómo las use cada uno, lo cierto es que es fundamental conocer de las herramientas de las que disponemos. La herramienta fundamental es la luz, y por lo tanto nos podemos valer de cualquier cosa que emita, transforme o elimine luz.Fotométria:
se encarga del estudio de la estimulación óptica que logra realizar la radiación electromagnética, es decir, mide la capacidad de la luz para incidir un brillo que estimule al ojo humano, permitiéndonos identificar las longitudes de ondas de luz que pueden ser perceptibles por el sentido de la vista, esto nos permite crear una tabla de las diferentes longitudes de onda a las que es sensible el ojo llamado “espectro visible” el cual oscila entre 400 y 750 mm.
domingo, 21 de febrero de 2016
Ejercicio

Un sistema termodinámico intercambia energía con los alrededores.
a) Calcular la variación de la energía interna cuando absorbe 90 cal, y realiza un trabajo de 420 joule sobre los alrededores.

1j. ------- 0.24 cal.

b) Absorbe 200 cal. y los alrededores realizan un trabajo sobre este de 520 joule.
375 j--------------- 90 cal

c) Libera 75 cal. y los alrededores realizan un trabajo sobre este de 312.5 joule.

Preguntas
Explicar con sus propias palabras que pasa con el volumen, la presión y temperatura en cada uno de los procesos termodinámicos.
la presión es el resultado de todos esos empujones… si hay el doble de empujones cada segundo, ¡la presión se habrá duplicado! Cuando el pistón haya bajado a la mitad de su altura inicial, es decir, cuando el volumen sea la mitad, se alcanzará de nuevo el equilibrio. Por un lado, ahora hay el doble de presión sobre el gas, con cuatro pesas en vez de dos, pero la reducción del volumen ha duplicado la presión que ejerce el gas, con lo que el pistón se quedará de nuevo quieto sin que tengamos que utilizar nuestros topes para conseguirlo
Proceso isobárico.
Al aumentar la temperatura, las moléculas del gas empezarán a moverse más y más rápido, y los impactos sobre el pistón serán más frecuentes y más intensos, como sucedía cuando manteníamos el volumen constante. Sin embargo, ahora lo que permanece constante es la presión de las pesas, y el pistón puede moverse. con lo que irá ascendiendo, empujado por impactos que las pesas no pueden compensar. Pero, según el pistón sube, los impactos tardan más en producirse, ya que las moléculas tienen que recorrer mayor distancia media entre impacto e impacto, con lo que llega un momento en el que las pesas pueden compensar la presión del gas.
Proceso isocórico
fijar el volumen de gas en nuestra máquina, pero eso lo tenemos muy fácil gracias a su revolucionario diseño: no tenemos más que fijar los topes sobre el pistón, evitando que pueda moverse, y el volumen será necesariamente constante durante el proceso (que será, por tanto, isocórico). Si modificamos entonces la presión o la temperatura (cambiando el número de pesas o alterando la temperatura del foco térmico) podremos ver qué le sucede a la otra magnitud variable.
Explicar por que cada proceso tiene diferente pared
Pared diatérmicas:
Es una conductora de calor, ésta permite el intercambio de calor entre el sistema y sus alrededores y al revés.
Pared adiabática:
Es caracterizada por no permitir la interacción térmica del sistema con los alrededores. Es construida de materiales no conductores del calor como porcelana o asbesto.Cual es la unidad de medida del calor y trabajo. ¿Por que tienen una equivalencia?
El calor es una forma de energía, y sus unidades de medida son el Joule (J) y la caloría (cal) (1 cal = 4,186 J) que fue definida en su momento para el calor cuando no se había establecido que era una forma de energía.
Se considera un gas contenido en un cilindro provisto de un pistón, sobre el cual actúa la presión atmosférica P, cuando la temperatura del gas aumenta, el gas se expande a presión constante, cuando el gas se expande ejerce una fuerza F sobre el pistón y le produce un incremento en su volumen ∆V, de tal modo que el trabajo realizado por el gas sobre el pistón está dado por: W = P*∆V
La relación entre la cantidad de calor producido y el trabajo realizado es una constante llamada equivalente mecánico del calor.
Como se considera el trabajo en cada uno de los procesos termodinámicos.
Proceso adiabático.
Se designa como proceso adiabático a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico.
Proceso isotérmico.
En este proceso la temperatura permanece constante. Como la energía interna de una gas ideal sólo es función de la temperatura, en un proceso isotérmico de un gas ideal la variación de la energía interna es cero (∆U= 0) La curva hiperbólica se conoce como isotérmica.
Proceso isobárico.
Es un proceso termodinámico en el cual la presión permanece constante, en este proceso, como la presión se mantiene constante, se produce una variación en el volumen y por tanto el sistema realiza trabajo o se puede realizar trabajo sobre el sistema.
Proceso isocórico
En este proceso el volumen permanece constante, es decir que en este tipo de proceso el volumen no varía y por tanto el trabajo es igual a cero, lo que significa que W= 0.
Resumen de los Procesos Termodinamicos

Procesos Termodinámicos
es el que comprende correctamente el comportamiento y la relación que se da entre temperatura, presión y volumen. Por ejemplo: el comportamiento de gases ante estas variables permite elegir los combustibles mas edoneos para mejorar el funcionamiento de diversas maquinas térmicas, como el refrigerador.
Termodinámica:
es la rama de la física que se encarga de el estudio de la transformación del calor en el trabajo mecánico y viceversa. su base principal es la conservación de la energía.
Sistema Termodinámico:
es una parte de el universo que se separa con la finalidad de poderla estudiar, para ellos se alista de los alrededores a través de fronteras. por ejemplo: un sistema puede ser un recipiente cualquiera.
Frontera:
es el limite que separa al sistema de los alrededores. generalmente son paredes que pueden ser diatermicas o adiabáticas
Pared Diatermica:
es una buena conductora de calor. permite el intercambio de calor entre el sistema y sus alrededores y viceversa.
Pared Adiabática:
se caracteriza por no permitir la interacción térmica del sistema con los alrededores.
Equilibrio Termodinámico:
se alcanza después de el cierto tiempo de poner en contacto un sistema a baja temperatura con otro sistema a mayor temperatura igualan.
Energía Interna:
es la energía contenida en el interior de las sustancias. se define como la suma de energía cinética y potencial de las moléculas individuales que la forman.
Equivalente Mecánico de Calor:
es representado por las anteriores equivalencias que indican la cantidad de energía mecánica que se transforma o se disipa en forma de calor, esto es por cada joule de trabajo se producen 0.24 calorías y cuando una caloría de energía calorífica se transforma se obtiene de 3.2 joule.
Procesos Termodinamicos

TERMODINÁMICA:
También es conocida como el movimiento del calor, en esta rama de la física se estudia la transferencia de calor en trabajo mecánico y viceversa. su principal base es la conservación de la energía. Nos proporciona una teoría básica que nos sirve para entender y poder diseñar maquinas térmicas (refrigeradores, cohetes, etc.).
La primera ley de termodinámica es la misma ley del principio de conservación de la energía, la cual exige que para todo sistema termodinámico se cumpla:
∆U = Q-W
Siendo ∆U la energía interna del sistema.
Se considera un gas contenido en un cilindro provisto de un pistón, sobre el cual actúa la presión atmosférica P, cuando la temperatura del gas aumenta, el gas se expande a presión constante, cuando el gas se expande ejerce una fuerza F sobre el pistón y le produce un incremento en su volumen ∆V, de tal modo que el trabajo realizado por el gas sobre el pistón está dado por:
W = P*∆V
Procesos termodinámicos.
Proceso adiabático.
Se designa como proceso adiabático a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico.
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de una llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar de que se consiga variar la temperatura del aire y su humedad relativa.
Durante un proceso adiabático, la energía interna del fluido que realiza el trabajo debe necesariamente decrecer.
Es decir, que en este tipo de procesos se tiene que Q = 0. Que de acuerdo con la primera ley de la termodinámica, tenemos que:
Q= ∆U +W
Como Q =0, entonces, ∆U = -W.
Esto quiere decir, que para un gas contenido en un cilindro provisto de un pistón, cuyas paredes no permiten la transferencia de calor al exterior, la variación de energía interna es igual al trabajo, ya sea realizado por el sistema o sobre el sistema.
Proceso isotérmico.
En este proceso la temperatura permanece constante. Como la energía interna de una gas ideal sólo es función de la temperatura, en un proceso isotérmico de un gas ideal la variación de la energía interna es cero (∆U= 0) La curva hiperbólica se conoce como isotérmica.
De acuerdo con la primera ley de la termodinámica tenemos:
Q = ∆U +W.
Como ∆U = 0, entonces, Q = W
Este proceso se observa cuando en un pistón que contiene un gas, después de suministrarle calor y producir cambios tanto en la presión como en el volumen su temperatura permanece constante.
Proceso isobárico.
Es un proceso termodinámico en el cual la presión permanece constante, en este proceso, como la presión se mantiene constante, se produce una variación en el volumen y por tanto el sistema realiza trabajo o se puede realizar trabajo sobre el sistema.
De acuerdo con la primera ley de la termodinámica, tenemos:
Q = ∆U +W
Lo que quiere decir que en un proceso de tipo isobárico tanto el calor transferido como el trabajo realizado ocasionan una variación de la energía interna.
Proceso isométrico
En este proceso el volumen permanece constante, es decir que en este tipo de proceso el volumen no varía y por tanto el trabajo es igual a cero, lo que significa queW= 0.
De acuerdo con la primera ley de la termodinámica tenemos:
Q = ∆U +W
Como W=0, entonces Q = ∆U
Ejemplos.
1. Sobre un gas contenido en un cilindro provisto de un pistón se realiza un trabajo de 5000 J, mediante un proceso isotérmico. Determinar:
a. La variación de la energía interna del gas.
b. El calor absorbido o cedido por el gas.
Solución:
a. Puesto que el proceso es isotérmico, se tiene que ∆U = 0, luego la energía interna no varía.
b. Como el trabajo se realiza sobre el gas W = -5000 J, por tanto,
Q = ∆U + W
Q = -5000J
Puesto que el calor es negativo, concluimos que el gas cede calor y su valor es 5000J.
Preguntas
El gas real, en cambio, es aquel que posee un comportamiento termodinámico y que no sigue la misma ecuación de estado de los gases ideales. Los gases se consideran como reales a presión elevada y poca temperatura.
En condiciones normales de presión y temperatura, en cambio, los gases reales suelen comportarse en forma cualitativa del mismo modo que un gas ideal. Por lo tanto, gases como el oxígeno, el nitrógeno, el hidrógeno o el dióxido de carbono se pueden tratar como gases ideales en determinadas circunstancias.
2.- Cuando se usa una olla express ¿Que leyes de gases intervienen?¿Por que?¿En que momento?
Interviene la ley de boyle, ley de gay-lussac y ley de charles
porque en la ley de boyle la presión y el volumen es constante y la temperatura es proporcional al volumen y la presión es proporcional a la temperatura.
la ley de boyle dice que a medida que aumenta la presión el volumen disminuye, esto quiere decir en una olla de presión que la presión es directamente proporcional a la temperatura a medida que amanta el calor dentro de la olla, el agua empieza a bullir y como está sellada herméticamente aumenta la presión y por la válvula se va saliendo el gas disminuyéndola sí el volumen de la misma.
la de gay lussac
Para una cierta cantidad de gas, al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo, es decir, aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar. Gay-Lussac descubrió que, en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
ley de charles: a presión constante, el volumen de un gas es proporcional al aumento de la temperatura: V/T=k
todas se cumplen
la de gay lussac
Para una cierta cantidad de gas, al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo, es decir, aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar. Gay-Lussac descubrió que, en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
ley de charles: a presión constante, el volumen de un gas es proporcional al aumento de la temperatura: V/T=k
todas se cumplen
Ley General de Los Gases
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante.
La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
En adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
donde:
donde:
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en kelvins)
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:
donde presión, volumen y temperatura se han medido en dos instantes distintos 1 y 2 para un mismo sistema.
En adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.
Diferentes unidades de medida para cada magnitud en las leyes de los gases ideales
La presión: Al aumentar la presión exterior, el punto de ebullición se eleva, pues se requiere una mayor agitación térmica(es decir, mayor temperatura) para que la presión de las burbujas contrarresten la presión externa. La presión también influye en el punto de fusión de las sustancias, de manera que, un incremento en la presión produce un incremento en el pinto de fusión de las sustancias
La temperatura: es una medida de energía cinética media de las moléculas que constituyen un cuerpo. Cuando la temperatura de un cuerpo aumenta, se produce un aumento en la velocidad con la que se mueve sus moléculas. Si el aumento de la temperatura se produce mediante suministro de calor, dicho aumento es proporcional a la cantidad de calor recibido, para un mismo aumento de moléculas.
Volumen: es una magnitud métrica de tipo escalar definida como la extensión en tres dimensiones de una región del espacio. Es una magnitud derivada de la longitud, ya que se halla multiplicando la longitud, el ancho y la altura. Matemáticamente el volumen es definible no sólo en cualquier espacio euclídeo, sino también en otro tipo de espacios métricos que incluyen por ejemplo a las variedades de Riemann. Desde un punto de vista físico, los cuerpos materiales ocupan un volumen por el hecho de ser extensos, fenómeno que se debe al principio de exclusión de Pauli.

Ley de avogadro
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
Vamos a suponer que aumentamos la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas aumentará la frecuencia de los choques con las paredes del recipiente lo que implica (por un instante) que la presión dentro del recipiente es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba inmediatamente.
Al haber ahora mayor distancia entre las paredes (es decir, mayor volumen del recipiente) el número de choques de las moléculas contra las paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la animación anterior, también podemos expresar la ley de Avogadro así:
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:

Ley de Gay- Lussac
Joseph Louis Gay-Lussac fue un físico francés que en el año de 1802 observó que todos los gases se expanden a una misma fracción de volumen para un mismo aumento en la temperatura, lo que le reveló la existencia de un coeficiente de expansión térmica común.
La ley de Gay- Lussac establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.

En un recipiente rígido, a volumen constante, la presión se dobla al duplicar la temperatura absoluta.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
 Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Las temperaturas han de expresarse en Kelvin.
La ley de Gay- Lussac establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.

En un recipiente rígido, a volumen constante, la presión se dobla al duplicar la temperatura absoluta.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
 Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Las temperaturas han de expresarse en Kelvin.
lunes, 8 de febrero de 2016
Ley de Charles
Jacques Alexander César Charles físico y químico francés, fue profesor de física en París. Colaboró con la construcción del primer globo aerostático llenado con hidrógeno. En el año de 1787 descubrió por primera vez lar elación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía. Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.Matemáticamente podemos expresarlo así:
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:


Como podemos apreciar en la figura anteriormente mostrada, tenemos un volumen y temperatura inicial, pero al aplicarle una fuente calorifica observamos que el volumen y temperatura no son las mismas. Es evidente que al calentar un gas, éste aumenta su volumen.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
Ley de Boyle
La primera ley es: Ley de Boyle, fue descubierta por Robert Boyle en 1662, que era un filósofo natural, químico, físico e inventor irlandés que formula la ley que lleva su apellido, ésta ley establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. Cabe mencionar que Edme Mariotte también llegó a la misma conclusión que Robert, pero no publicó sus trabajos hasta 1676, por eso en ciertos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:

Relaciona inversamente las proporciones de presión y volumen de un gas, manteniendo la temperatura constante. (Que es otra manera de expresar la Ley de Boyle)

cuando se somete a un gas a una presión de 4 atmósferas, su volumen disminuye, con esto podemos concluir que a mayor presión MENOR es el volumen.

Se observa que cuando se disminuye la presión a 1 atmósfera, el volumen aumenta, debido a que los gases son compresibles. Por lo tanto a menor presión MAYOR volumen.
Leyes De Los Gases
La determinación de una ecuación de estado de los gases implica inevitablemente la medición de la presión, o fuerza por unidad de área, que un gas ejerce sobre las paredes del recipiente que lo contiene. La presión de los gases comúnmente se expresa en atmósferas o milímetros de mercurio.
El estudio sistemático del comportamiento de los gases le interesó a los científicos durantes siglos. Destacan los nombres de varios investigadores que establecieron las propiedades de los gases, de los cuales se hablará a continuación.
lunes, 1 de febrero de 2016

El propósito de elaboración de este Blog es, aparte de aplicar nuestros previos conocimientos por parte del área de soporte la cual eh permanecido a lo largo de mi estancia en la escuela, también es publicar información sobre temas asignados en la materia de Física.
La información que le ofrezco es un breve resumen. Al igual que se complementa con ejemplos y algunos ejercicios para reforzar nuestros conocimientos para que se entienda de una manera mas sencilla.
Suscribirse a:
Comentarios (Atom)