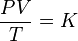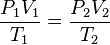TERMODINÁMICA:
También es conocida como el movimiento del calor, en esta rama de la física se estudia la transferencia de calor en trabajo mecánico y viceversa. su principal base es la conservación de la energía. Nos proporciona una teoría básica que nos sirve para entender y poder diseñar maquinas térmicas (refrigeradores, cohetes, etc.).
Primera ley de la termodinámica.
La primera ley de la termodinámica establece que, cuando se añade calor Q a un sistema mientras éste efectúa trabajo W, la energía interna U cambia en una cantidad igual a Q – W.
La primera ley de termodinámica es la misma ley del principio de conservación de la energía, la cual exige que para todo sistema termodinámico se cumpla:
∆U = Q-W
Siendo ∆U la energía interna del sistema.
Se considera un gas contenido en un cilindro provisto de un pistón, sobre el cual actúa la presión atmosférica P, cuando la temperatura del gas aumenta, el gas se expande a presión constante, cuando el gas se expande ejerce una fuerza F sobre el pistón y le produce un incremento en su volumen ∆V, de tal modo que el trabajo realizado por el gas sobre el pistón está dado por:
W = P*∆V
Procesos termodinámicos.
Proceso adiabático.
Se designa como proceso adiabático a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico.
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de una llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar de que se consiga variar la temperatura del aire y su humedad relativa.
Durante un proceso adiabático, la energía interna del fluido que realiza el trabajo debe necesariamente decrecer.
Es decir, que en este tipo de procesos se tiene que Q = 0. Que de acuerdo con la primera ley de la termodinámica, tenemos que:
Q= ∆U +W
Como Q =0, entonces, ∆U = -W.
Esto quiere decir, que para un gas contenido en un cilindro provisto de un pistón, cuyas paredes no permiten la transferencia de calor al exterior, la variación de energía interna es igual al trabajo, ya sea realizado por el sistema o sobre el sistema.
Proceso isotérmico.
En este proceso la temperatura permanece constante. Como la energía interna de una gas ideal sólo es función de la temperatura, en un proceso isotérmico de un gas ideal la variación de la energía interna es cero (∆U= 0) La curva hiperbólica se conoce como isotérmica.
De acuerdo con la primera ley de la termodinámica tenemos:
Q = ∆U +W.
Como ∆U = 0, entonces, Q = W
Este proceso se observa cuando en un pistón que contiene un gas, después de suministrarle calor y producir cambios tanto en la presión como en el volumen su temperatura permanece constante.
Proceso isobárico.
Es un proceso termodinámico en el cual la presión permanece constante, en este proceso, como la presión se mantiene constante, se produce una variación en el volumen y por tanto el sistema realiza trabajo o se puede realizar trabajo sobre el sistema.
De acuerdo con la primera ley de la termodinámica, tenemos:
Q = ∆U +W
Lo que quiere decir que en un proceso de tipo isobárico tanto el calor transferido como el trabajo realizado ocasionan una variación de la energía interna.
Proceso isométrico
En este proceso el volumen permanece constante, es decir que en este tipo de proceso el volumen no varía y por tanto el trabajo es igual a cero, lo que significa queW= 0.
De acuerdo con la primera ley de la termodinámica tenemos:
Q = ∆U +W
Como W=0, entonces Q = ∆U
Ejemplos.
1. Sobre un gas contenido en un cilindro provisto de un pistón se realiza un trabajo de 5000 J, mediante un proceso isotérmico. Determinar:
a. La variación de la energía interna del gas.
b. El calor absorbido o cedido por el gas.
Solución:
a. Puesto que el proceso es isotérmico, se tiene que ∆U = 0, luego la energía interna no varía.
b. Como el trabajo se realiza sobre el gas W = -5000 J, por tanto,
Q = ∆U + W
Q = -5000J
Puesto que el calor es negativo, concluimos que el gas cede calor y su valor es 5000J.