La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante.
La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
En adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
donde:
donde:
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en kelvins)
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
Otra forma de expresarlo es la siguiente:
donde presión, volumen y temperatura se han medido en dos instantes distintos 1 y 2 para un mismo sistema.
En adición de la ley de Avogadro al rendimiento de la ley de gases combinados se obtiene la ley de los gases ideales.

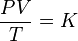
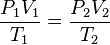
No hay comentarios:
Publicar un comentario